Pengertian Protein, Contoh, Struktur, Sifat, Bentuk, Jenis, Fungsi, Denaturasi, Renaturasi, Kimia
Pengertian Protein, Contoh, Struktur, Sifat, Bentuk, Jenis, Fungsi, Denaturasi, Renaturasi, Kimia - Protein adalah polimer biologi yang tersusun atas molekul-molekul kecil (asam amino). Rentang massa molekul protein berkisar dari 6.000 hingga puluhan ribu. Selain tersusun atas asam amino, banyak protein juga mengandung komponen lain seperti ion logam (misalnya Fe2+, Zn2+, Cu2+, dan Mg2+) atau mengandung molekul organik kompleks, biasanya turunan dari vitamin.
1. Asam Amino
Asam amino adalah molekul yang mengandung gugus amino (–NH2) dan gugus karboksil (–COOH). Asam amino disebut juga asam α-amino yang merupakan monomer dari protein (polipeptida). Struktur umum asam amino ditunjukkan pada Gambar 1.
 |
| Gambar 1. Struktur umum asam amino. |
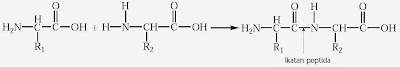
Di dalam protein, asam-asam amino diikat bersama melalui ikatan peptida, yaitu ikatan C–N hasil reaksi kondensasi antara gugus karboksil dengan gugus amino dari asam amino lain. Perhatikan reaksi kondensasi berikut.
Reaksi tersebut merupakan contoh dipeptida, yaitu molekul yang dibentuk melalui ikatan peptida dari dua asam amino. Suatu polipeptida (protein) adalah polimer yang dibentuk oleh sejumlah besar asam amino melalui ikatan peptida membentuk rantai polimer.
Penamaan dipeptida atau tripeptida disesusaikan dengan nama asam amino yang berikatan. Huruf akhir dari nama asam amino yang disatukan diganti dengan huruf l’. Contoh, jika alanin dan glisin menjadi dipeptida, nama dipeptidanya adalah alanilglisin.
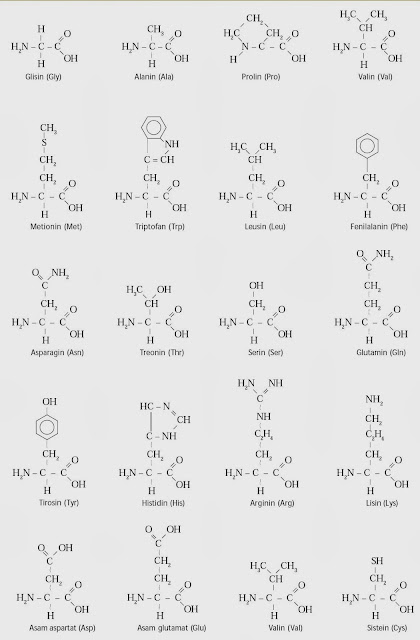
Terdapat 20 macam asam amino yang ditemukan pada protein. Setiap asam amino berbeda dalam hal gugus R, atau rantai samping. Rantai samping menentukan sifat-sifat asam amino.
Nama-nama asam amino lebih dikenal dengan nama trivial daripada nama sistematisnya (IUPAC) sebab lebih sederhana dan mudah diingat. Singkatan nama asam amino diambil tiga huruf dari nama asam amino. Sembilan dari asam amino bersifat nonpolar dan asam amino lainnya bersifat polar sehingga dapat terionisasi atau membentuk ikatan hidrogen dengan asam amino lain atau dengan air. Terdapat sepuluh macam asam amino esensial (asam amino yang dibutuhkan oleh tubuh dan tidak dapat disintesis oleh tubuh, tetapi harus dikonsumsi dari makanan). Kesepuluh asam amino tersebut, yaitu valin, leusin, isoleusin, lisin, histidin, fenilalanin, triftofan, treonin, metionin, dan arginin (hanya diperlukan oleh anak-anak yang sedang tumbuh).
Tabel 1. Komposisi Unsur dalam Kuning Telur
Unsur | C | H | N | O | S |
Persentase (%) | 50–55 | 7–8 | 15–19 | 19–24 | 0–2,5 |
2. Sifat Asam Amino
Hampir semua asam amino, kecuali glisin mempunyai atom karbon tidak simetris (kiral), yaitu atom karbon yang keempat valensinya mengikat atom atau gugus berbeda. Atom karbon tidak simetris dalam asam amino, yaitu atom karbon alfa yang mengikat empat macam gugus, seperti gugus karboksil, gugus amino, atom hidrogen, dan gugus R.
 |
| Gambar 2. Atom karbon kiral (keempat valensinya mengikat gugus berbeda). |
Asam amino tidak simetris memiliki dua bentuk isomeri, di mana sifat fisika dan kimia mirip, kecuali kemampuan membedakan arah putar bidang polarisasi, disebut juga sebagai senyawa optis aktif. Senyawa yang memiliki isomeri optis dinamakan isomer optis atau stereoisomer.
Asam amino yang dapat memutar bidang cahaya terpolarisasi ke kiri, disebut isomeri levorotary (l) atau (–), jika pemutaran bidang cahaya ke kanan dinamakan de trorotary (d) atau (+). Perhatikan Gambar 3.
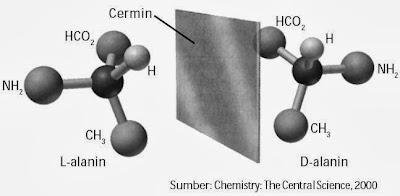 |
| Gambar 3. Alanin memiliki atom C kiral. Lalanin dan D-alanin pada cermin tampak sama, seperti tangan kiri dan tangan kanan yang berhadapan. |
Oleh karena asam amino mengandung gugus amino dan gugus karboksil, semua asam amino akan memberikan reaksi positif dari kedua gugus ini. Keadaan ini dapat digunakan untuk mengidentifikasi asam amino dalam protein.
3. Struktur dan Bentuk Protein
Struktur protein dapat dikelompokkan menjadi empat golongan, yaitu struktur primer, sekunder, tersier, dan kuarterner. Struktur primer adalah struktur linear dari rantai protein. Dalam struktur ini tidak terjadi antaraksi, baik dengan rantai protein yang lain maupun di antara asam amino dalam rantai protein itu sendiri.
 |
| Gambar 4. Struktur primer dari protein. |
Struktur sekunder adalah struktur dua dimensi dari protein. Pada struktur ini terjadi lipatan (folding) beraturan, seperti α–heliks dan β–sheet, akibat adanya ikatan hidrogen di antara gugus-gugus polar dari asam amino dalam rantai protein.
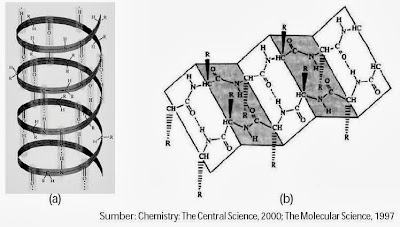 |
| Gambar 5. Struktur sekunder protein (a) Struktur α-heliks dari protein (b) Struktur β-sheet dari protein. |
Struktur tersier merupakan struktur tiga dimensi sederhana dari rantai protein. Dalam struktur ini, selain terjadi folding membentuk struktur α–heliks dan β–sheet, juga terjadi antaraksi van der Waals dan antaraksi gugus nonpolar yang mendorong terjadi lipatan.
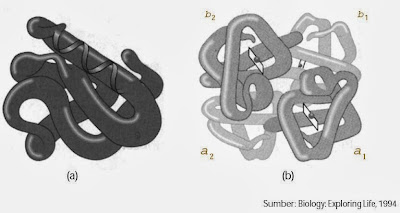 |
| Gambar 6. (a) Struktur tersier dari protein b) Struktur kuarterner dari protein hemoglobin dengan empat subunit (a1, a2, b1, b2) |
Struktur tertinggi dari protein adalah struktur kuarterner. Dalam struktur ini, protein membentuk molekul kompleks, tidak terbatas hanya pada satu rantai protein, tetapi beberapa rantai protein bergabung membentuk seperti bola.
Jadi, pada struktur kuartener molekul protein di samping memiliki ikatan hidrogen, gaya van der Waals, dan antaraksi gugus nonpolar, juga terjadi antaraksi antar rantai protein baik melalui antaraksi polar, nonpolar, maupun van der Waals. Contoh dari struktur ini adalah molekul Hemoglobin, tersusun dari empat subunit rantai protein.
4. Sifat Fisika dan Kimia Protein [1]
Sifat fisikokimia setiap protein tidak sama, tergantung pada jumlah dan jenis asam aminonya. Berat molekul protein sangat besar sehingga bila protein dilarutkan dalam air akan membentuk suatu dispersi koloidal. Molekul protein tidak dapat melalui membran semipermiabel, tetapi masing-masing dapat menimbulkan tegangan pada membran tersebut.
Ada protein yang larut dalam air, dan ada pula yang tidak larut dalam air, tetapi semua protein tidak larut dalam pelarut lemak seperti etil eter. Bila dalam suatu larutan protein ditambahkan garam, maka daya larut protein akan berkurang, akibatnya protein mengendap. Prinsip ini digunakan untuk memisahkan protein dari larutannya.
Proses pemisahan protein seperti ini disebut salting out. Garam-garam logam berat dan asam-asam mineral kuat ternyata baik digunakan untuk mengendapkan protein. Prinsip ini dipakai untuk mengobati orang yang keracunan logam berat dengan memberi minum susu atau makan telur mentah kepada pasien.
Apabila protein dipanaskan atau ditambahkan alkohol, maka protein akan menggumpal. Hal ini disebabkan alkohol menarik mantel air yang melingkupi molekul-molekul protein. Selain itu penggumpalan juga dapat terjadi karena aktivitas enzim-enzim proteolitik.
Adanya gugus amino dan karboksil bebas pada ujung-ujung rantai molekul protein, menyebabkan protein mempunyai banyak muatan (polielektrolit) dan bersifat amfoter (dapat bereaksi dengan asam maupun dengan basa). Daya reaksi berbagai jenis protein terhadap asam dan basa tidak sama, tergantung dari jumlah dan letak gugus amino dan karboksil dalam molekul. Dalam larutan asam (pH rendah), gugus amino bereaksi sebagai basa, sehingga protein bermuatan positif. Bila pada kondisi ini dilakukan elektrolisis, maka molekul protein akan bergerak ke arah katode. Sebaliknya, dalam larutan basa (pH tinggi) molekul protein akan bereaksi sebagai asam atau bermuatan negatif, sehingga molekul protein akan bergerak menuju anode. Pada pH tertentu yang disebut titik isolistrik (pI), muatan gugus amino, dan karboksil bebas akan saling menetralkan sehingga molekul bermuatan nol. Tiap jenis protein mempunyai titik isolistrik yang berlainan. Perbedaan inilah yang dijadikan pedoman dalam proses-proses pemisahan serta pemurnian protein.
4. Sifat Fisika dan Kimia Protein [1]
Sifat fisikokimia setiap protein tidak sama, tergantung pada jumlah dan jenis asam aminonya. Berat molekul protein sangat besar sehingga bila protein dilarutkan dalam air akan membentuk suatu dispersi koloidal. Molekul protein tidak dapat melalui membran semipermiabel, tetapi masing-masing dapat menimbulkan tegangan pada membran tersebut.
Unsur | Persentase (%) |
Karbon | 51,0 – 55 |
Hidrogen | 6,5 – 7,3 |
Nitrogen | 15,5 – 18 |
Oksigen | 21,5 – 23,5 |
Sulfat | 0,5 – 2,0 |
Phospat | 0,0 – 1,5 |
Ada protein yang larut dalam air, dan ada pula yang tidak larut dalam air, tetapi semua protein tidak larut dalam pelarut lemak seperti etil eter. Bila dalam suatu larutan protein ditambahkan garam, maka daya larut protein akan berkurang, akibatnya protein mengendap. Prinsip ini digunakan untuk memisahkan protein dari larutannya.
Proses pemisahan protein seperti ini disebut salting out. Garam-garam logam berat dan asam-asam mineral kuat ternyata baik digunakan untuk mengendapkan protein. Prinsip ini dipakai untuk mengobati orang yang keracunan logam berat dengan memberi minum susu atau makan telur mentah kepada pasien.
Apabila protein dipanaskan atau ditambahkan alkohol, maka protein akan menggumpal. Hal ini disebabkan alkohol menarik mantel air yang melingkupi molekul-molekul protein. Selain itu penggumpalan juga dapat terjadi karena aktivitas enzim-enzim proteolitik.
Adanya gugus amino dan karboksil bebas pada ujung-ujung rantai molekul protein, menyebabkan protein mempunyai banyak muatan (polielektrolit) dan bersifat amfoter (dapat bereaksi dengan asam maupun dengan basa). Daya reaksi berbagai jenis protein terhadap asam dan basa tidak sama, tergantung dari jumlah dan letak gugus amino dan karboksil dalam molekul. Dalam larutan asam (pH rendah), gugus amino bereaksi sebagai basa, sehingga protein bermuatan positif. Bila pada kondisi ini dilakukan elektrolisis, maka molekul protein akan bergerak ke arah katode. Sebaliknya, dalam larutan basa (pH tinggi) molekul protein akan bereaksi sebagai asam atau bermuatan negatif, sehingga molekul protein akan bergerak menuju anode. Pada pH tertentu yang disebut titik isolistrik (pI), muatan gugus amino, dan karboksil bebas akan saling menetralkan sehingga molekul bermuatan nol. Tiap jenis protein mempunyai titik isolistrik yang berlainan. Perbedaan inilah yang dijadikan pedoman dalam proses-proses pemisahan serta pemurnian protein.
5. Jenis dan Fungsi Protein
Oleh karena protein memiliki keanekaragaman sangat tinggi maka protein digolongkan berdasarkan sifat dan fungsinya, seperti protein sebagai enzim, protein transport, protein bahan makanan, protein kontraktil, protein struktural, protein regulator, dan protein pertahanan.
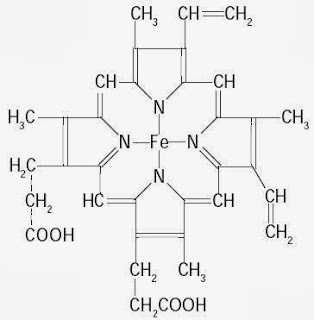 |
| Gambar 7. Struktur hemin yang terdapat pada hemoglobin, sebagai gugus pembawa oksigen. |
Enzim adalah jenis protein yang memiliki sifat sangat beragam, tetapi spesifik. Enzim berperan sebagai katalisis untuk berbagai reaksi biokimia. Hampir seluruh reaksi kimia dalam sel makhluk hidup dikatalisis oleh enzim. Sampai tahun 1980-an telah ditemukan lebih dari 2.000 macam enzim, masing-masing memiliki kemampuan khusus dalam mengkatalisis reaksi kimia.
Protein transport dalam plasma darah mengikat dan membawa molekul atau ion tertentu dari satu organ ke organ lain. Hemoglobin dalam sel darah merah mengikat oksigen pada saat darah memasuki paru-paru dan membawanya ke jaringan periferal. Pada jaringan tersebut oksigen dilepaskan untuk proses oksidasi bahan makanan.
Plasma darah mengandung lipoprotein yang membawa lipid dari hati ke organ lain. Protein yang terdapat pada membran sel juga merupakan protein transpor, berfungsi mentransportasikan glukosa, asam amino, dan nutrien lain melewati membran sel.
Sebagian protein dalam sel tersimpan dalam bentuk bahan makanan. Contohnya dalam biji-bijian, protein digunakan untuk pertumbuhan embrio tanaman. Albumin adalah protein utama dalam putih telur. Kasein merupakan protein terbesar dalam air susu. Semua protein tersebut merupakan protein bahan makanan.
Beberapa protein dalam sel dan organisme mempunyai fungsi untuk kontraksi. Contohnya, protein aktin atau miosin merupakan protein serabut yang berfungsi kontraksi otot. Tubulin adalah protein pembentuk mikrotubul yang merupakan komponen penting pada flagela dan silia untuk bergerak.
Beberapa protein berfungsi sebagai serabut atau pelindung, untuk memberikan kekuatan dan proteksi sel. Komponen utama dari jaringan tendon dan kartilago merupakan protein serat kolagen yang memiliki kekuatan atau kekenyalan tinggi. Kulit merupakan protein kolagen. Rambut dan kuku mengandung protein yang tidak larut dalam air, disebut keratin.
Komponen utama sutra dan jaring labah-labah merupakan protein fibroin. Beberapa protein berfungsi menjaga serangan organisme lain. Immunoglobin atau antibodi merupakan protein khusus yang dibuat oleh jaringan limfosit untuk mengenali dan mengendapkan atau menetralkan bakteri, virus, atau protein asing dari jenis lain. Fibrinogen dan trombin merupakan protein yang bertanggung jawab terhadap pembekuan darah.
6. Denaturasi dan Renaturasi Protein
Ikatan-ikatan yang lemah pada protein dapat pecah atau rusak akibat perlakuan tertentu. Hal ini dapat mengakibatkan suatu protein terlepas dari ikatannya. Peristiwa ini dinamakan denaturasi protein. Jika protein dipanaskan, kalor dapat memecahkan beberapa ikatan lemah, seperti ikatan hidrogen, gaya van der Waals, maupun antaraksi hidrofob antargugus asam amino dalam rantai protein (lihat Gambar 8.25).
Perubahan pH juga dapat merubah struktur protein sebab akan merubah muatan dari gugus rantai samping asam amino. Pada akhirnya, dapat mempengaruhi ikatan ionik maupun ikatan hidrogen. Pereaksi seperti larutan urea 8,0 M, dapat merusak, baik ikatan hidrogen maupun antaraksi hidrofob.
Protein yang terdenaturasi dapat diubah kembali membentuk struktur semula, jika molekul protein masih larut dalam larutan urea. Jika sedikit demi sedikit konsentrasi urea diturunkan melalui proses dialisis, protein terdenaturasi secara perlahan akan melakukan renaturasi kembali ke dalam bentuk semula.
7. Hermann Emil Fischer (1852–1919)
Fischer memberikan kontribusi yang besar bagi ilmu pengetahuan, khususnya tentang protein. Dia berjasa dalam penemuan asam amino golongan baru, yakni asam amino siklik yang meliputi prolin dan oksiprolin. Fischer juga meneliti sintesis protein melalui perolehan berbagai asam amino yang memiliki struktur optis aktif.
Referensi :
Sunarya, Y. dan A. Setiabudi. 2009. Mudah dan Aktif Belajar Kimia 3 : Untuk Kelas XII Sekolah Menengah Atas / Madrasah Aliyah. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 298.
Referensi Lainnya :
[1] Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Referensi Lainnya :
[1] Sukmanawati, W. 2009. Kimia 3 : Untuk SMA/ MA Kelas XII. Pusat Perbukuan, Departemen Pendidikan Nasional, Jakarta, p. 266.
Tag :
BIOLOGI

0 Komentar untuk "Pengertian Protein, Contoh, Struktur, Sifat, Bentuk, Jenis, Fungsi, Denaturasi, Renaturasi, Kimia"